ANALISIS KUALITATIF KATION GOLONGAN I
A. TUJUAN PENELITIAN
Setelah melakukan pratikum, diharapkan makasiswa dapat :
a. Mempelajari reaksi-reaksi spesifik kation golongan I.
b. Melakukan pemisahan terhadap kation golongan I dalam suatu sampel.
B. DASAR TEORI
Analisa kualitatif adalah proses dalam mendeteksi keberadaan suatu unsur kimia dalam sampel yang tidak diketahui. Cara ini merupakan salah satu cara yang paling bagus untuk mempelajari kimia beserta unsur-unsur dan ion dalam suatu larutan. Analisis ini dapat dilakukan dengan uji nyala dan analisis kation dengan dasar reaksi spesifikasi nya dengan reagen tertentu.
Analisis kation dilakukan dengan dua cara yaitu pemisahan dan identifikasi. Pemisahan dilakukan dengan mengendapkan kation dari larutannya. Endapan yang dihasilkan dipisahkan dengan larutannya dicuci dan dibuat larutan dengan cara memusing dengan sentrifius lalu membagi dua hasi penyaringan. Larutan yang masih memiliki kation lain kemudian diendapkan lagi sehingga dibetuk kelompok kation baru. Jika dalam kelompok tersebut masih ada kation lain, proses pengendapan dilakukan lagi sehingga memiliki satu kation saja. Jenis konsentrasi pereaksi serta pengaturan pH larutan dilakukan untuk memisahkan kation menjadi beberapa kelompok.
Dalam analisis kualitatif, kation-kation dapat diklasifikasikan menjadilima golongan berdasarkan reaksi spesifikasi sifat-sifat kation terseut terhadap pereaksi tertentu. Dengan menggunakan pereaksi-peresaksi tersebut, dapat ditetapkanada atau tidaknya suatu kation dan juga dapat memisahkan kation-kation untuk pemeriksaan lebih lanjut.
Reagen golongan yang dipakai untuk klasifikasi kation yang paling umum adalah asam klorida (HCl), amonium sulfida (NH4)2S), hidrogen sulfida (H2S), dan amonium karbonat ((NH4)2CO3). Klasifikasi ditentukan oleh reaksi dengan reagen-reagen di atas dengan melihat apakah ada endapannya atau tidak. Sehingga dengan reaksi tersebut dapat di bedakan lima golongan kation berdasarkan sifat-sifat kation terhadap reagennya.
1. Golongan I
Kation golongan I : Timbal (II), Merkurium (I), dan Perak (I).
Pereaksi golongan : Asam Klorida (HCl)
Reaksi golongan : Endapan putih dari merkurium klorida (Hg2Cl2), Perak Klorida (AgCl), dan Timbal Klorida (PbCl2).
Kation golongan I membentuk klorida-klorida yang taidak larut. Akan tetapi timbal klorida akan sedikit larut dalam air. Hal ini dikarenakan timbal tidak pernah mengendap dengan sempurna bila di tambahkan dengan asam klorida encer. Cuplikan ion timbal yang tersisa diendapkan secara kuantitaif dalam H2S dalam suasana asam bersama kation golongan II.
Nitrat golongan I sangat mudah larut dan diantara sulfat-sulfat, timbal tidak larut.sedangkan perak sulfida, jauh lebih banyak endapannya. Kelarutan merkurium (I) sulfat terletak di antara kedua zat di atas. Iodide dan bromide juga tidak larut. Sedang pengendapan timbal halida mengendap tidak sempurna dan endapan itu mudah sekali larut dalam air panas. Sulfida tidak larut, sedangkan asetat lebih mudah tidak larut meskipun perak asetat bisa mengendap dari larutan yang agak pekat. Karbonat da hidroksida adan diendapkan dengan reagen yang ekuivalen.
2. Golongan II
Kation golongan II : Merkurium (III), tembaga, bismud, kadmium, arsenic (III), arsenic (V), stibium (III), stibium (V), timah (II), dan timah (V).
Golongan ini bereaksi dengan asam klorida, namun akan mengendap dengan hidrogen sulfidadalam suasana asam mineral encer. Kation golongan ini dapat di bagi atas 2 sub golongan yaitu sub golongan tembaga (IIA) dan sub golongan arsenic (IIB). Sub golongan ini di bagi berdasarkan larut atau tidak larutnya dalam amonium polisulfida (NH4)2S2. Golongan tembaga antara lain Hg2+, Cu3+, Bi2+,Cd2+, sedangkan golongan arsenic yaitu As3+,As5+, Sb3+, Sb5+,Sn2+,Sn4+.
3. Golongan III
Kation golongan III tidak larut atau mengendap dalam amonium sulfida (NH4)2S2 dalam suasana netral. Kation golongan ini yaitu Co2+, N2+, Fe3+, Fe2+, Cr3+, Al3+, Zn3+, dan Mn3+.
4. Golongan IV
Kation golongan ini tidak larut dalam Amonium Karbonat (NH4)2CO3 dalam suasana netral atau sedikit asam. Kation golongan ini barium (Ba2+), kalsium (Ca2+), dan Stronsium (Sr2+).
5. Golongan V
Kation golongan V tidak bereaksi dengan asam reagen-reagen yang di pakai dalam golongan I, II, III, IV. Kation golongan ini adalah Magnesium (Mg2+), Natrium (Na+), kalium (K+), amonium (NH4+), dan litium (Li+).
Reaksi-reaksi khusus dan uji nyala dapat dipakai untuk mengidentifikasi ion-ion dan kation golongan ini.Mg memperlihatkan reaksi-reaksi yang serupa dengan reaksi-reaksi dari golongan keempat. Magnesium karbonat dengan adanya garam ammonium dapat larut. Reaksi magnesium tak akan mengendap bersama kation golongan IV. Reaksi ion ammonium sangat serupa dengan reaksi-reaksi ion kalium, karena jari-jari ion dari kedua ion ini hamper identik
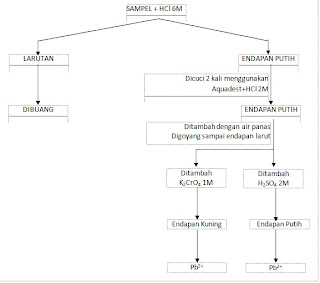
Pada percobaan kali ini lebih ditekankan pada pemisahan dan identifikasi kation golongan I yang menggunakan reaktan asam klorida (HCl). Endapan yang terbentuk pada golongan ini adalah PbCl2, Hg2Cl2, dan AgCl. Endapan PbCl2 larut dengan kenaikan suhu. Oleh sebab itu PbCl2 dapat dipisahkan dari kedua kation yang lain dengan penambahan air panas kemudian memusingkannya dan memisahkannya. Keberadaan Pb2+ dapat di identifikasi dengan penambahan K2CrO4 1M sehingga terbentuk endapan kuning, atau dengan penambahan H2SO4 2M sehingga akan terbentuk endapan putih.
AgCl dapat dipisahkan dari Hg2Cl2 dengan melarutkan NH4OH dengan AgCl larut sehingga akan membentuk Ag(NH3)2+. Sedangkan keberadaan Ag+ dapat di uji dengan penambahan HNO3 2M yang nantinya akan membentuk endapan putih. Selain itu juga dapat dengan penambahan KI yang nantinya akan memberikan endapan kuning.
Hg2Cl2dapat dipisahkan dengan menggunakan NH4OH. Buktinya akan terbentuk endapan hitam atau dapat dikatakan tidak larut. Dengan adanya endapan hitam dapat dikatakan bahwa sampel tersebut mengandung Hg.
C. PROSEDUR KERJA
1. Alat
a. Sentrifus
b. Tabung reaksi
c. Lampu spritus
d. Rak tabung reaksi
e. Botol reagen
f. Kaca arloji
g. Corong
2. Bahan
a. HCl 6M dan 2M
b. AgNO3, Hg2(NO3)2 dan Pb(NO3)2
c. K2CrO4 1M
d. NH4OH 2M
e. H2SO4 2M
f. HNO3 2M
g. KI
3. Cara Kerja
a. Larutan sampel dibagi dua.
b. Setengah bagian dari sampel ditambah dengan 1 tetes HCl 6M. Sehingga akan terbentuk endapan putih di dasar tabung reaksi.
c. Buang larutan di dalam tabung reaksi sehingga tertinggal hanya endapan putih saja.
d. Cuci endapan dengan aquades yang telah ditambah dengan HCl 2M sebanyak 2 kali pencucian dengan pemusingan dengan sentrifius.
e. Pisahkan larutan dengan endapan. Sehingga akan didapatkan endapan berupa AgCl dan Hg2Cl2. Sedang larutan berkemungkinan mengandung PbCl2. Larutan dan endapan ini di dapat setelah pemusingan dengan menggunakan air panas.
f. Larutan yang setelah pemusingan tidak memiliki endapan mengandung PbCl2. Selanjutnya larutan yang di dapat dibagi menjadi 2 bagian.
I. Larutan tabung A ditambah dengan K2CrO4 1M sehingga terbentuk endapan kuning pada dasar tabung reaksi.
II. Larutan tabung B ditambahkan dengan H2SO4 2M sehingga akan terbentuk endapan putih pada dasar tabung reaksi.
g. Pada endapan yang diperkira mengandung AgCl dan Hg2Cl2 di tambahkan NH4OH. Jika terdapat endapan hitam, maka telah dapat dipastikan bahwa endapan mengandung Hg.
h. Selanjutnya jika endapan di perkirakan mengandung Ag(NH3)2+, sampel endapan di bagi 2.
I. Endapan A ditambahkan HNO3 2M, jika terbentuk endapan putih maka sampel mengandung Ag.
II. Endapan B ditambahkan KI, jika terbentuk endapan kuning maka sampel mengandung Ag.
4.
|
|
|
D. DATA PERCOBAAN
NO
|
PERLAKUAN
|
REAKSI
|
HASIL PENGAMATAN
|
1.
|
SAMPEL + HCl 6M
|
AgNO3(aq)+HCl(aq)®AgCl(s)+HNO3(aq)
Hg2+(aq)+2Cl-(aq) ®Hg2Cl2(s)
Pb(NO3)2(aq)+HCl(aq) ®PbCl2(s)+2HNO3(aq)
|
Larutan bening serta terbentuk endapan putih.
|
2.
|
Endapan putih+aquadest+HCl 2M, dan didihkan.
|
Larutan bening, endapan hilang.
| |
3
|
Bagi dua larutan dengan tabung reaksi :
a. Tabung A + H2SO4 2M
b. Tabung B + K2CrO4 1M
|
Pb2+(aq)+SO42-(aq) ®PbSO4(s)
Pb2+(aq)+CrO42-(aq) ®PbCrO4(s)
|
a. Terbentuk endapan putih PbSO4.
b. Larutan berwarna kuning dan endapan kuniang PbCrO4.
|
E. PEMBAHASAN
Berdasarkan data dari hasil percobaan yang telah dilakukan, maka diperoleh bahwa :
Pb(NO3)2(aq)+HCl(aq) ®PbCl2(s)+2HNO3(aq)
Reaksi dengan HCl 6M akan menghasilkan endapan putih timbal klorida (PbCl2) dalam larutan. Setelah larutan di pisahkan dengan endapan, cuci endapan dua kali dengan menggunakan aquades yang telah ditambahkan HCl 2M. Endapan tersebut ditambahkan dengan air panas lalu di pusingkan dengan menggunakan sentrifius sehingga endapan menghilang. Larutan dibagi kepada dua tabung reaksi dan masing-masing tabung ditambahkan dengan 1 tetes larutan H2SO4 2M dan K2CrO4 1M dengan reaksi :
a. Tabung A + larutan H2SO4 2M.
Pb2+(aq)+SO42-(aq) ®PbSO4(s)
Menhasilkan endapan putih (timbel sulfat) yang membuktikan bahwa sampel mengandung Pb2+.
b. Tabung B + larutan K2CrO4 1M.
Pb2+(aq)+CrO42-(aq) ®PbCrO4(s)
Menghasilkan endapan kuning (timbel kromat) yang membuktikan sampel mengandung Pb2+.
F. KESIMPULAN DAN SARAN
1. Kesimpulan
a. Kation golongan I terdiri atas Timbal (II), Merkurium (I), dan Perak (I). Untuk memisahkan kation dari golongan ini dengan penambahan HCl 6M.
b. Sampel pada percobaan ini hanya mengandung Pb2+, karena larutan didapat setelah dilakukan pemanasan, dan ketika ditambahkan K2CrO4 1M ternyata terbentuk endapan kuning dan dengan penambahan H2SO4 2M terbentuk endapan putih.
2. Saran
a. Sebaiknya semua sampel diberi label. Sehingga tidak terjadi kekeliruan dalam penelitian.
Tidak ada komentar:
Posting Komentar